聚焦创新与质量 解读国家药监局2019年度药品审评报告
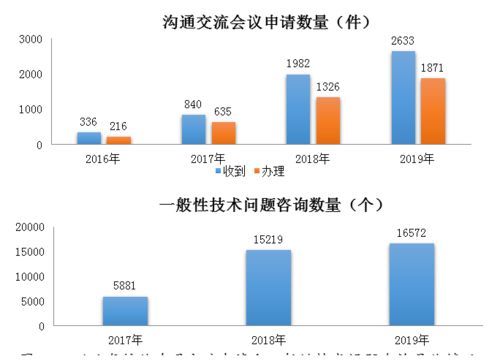
国家药品监督管理局(NMPA)正式发布了《2019年度药品审评报告》,这份报告不仅是对过去一年药品审评审批工作的全面总结,更是观察中国医药产业发展趋势与技术开发前沿的重要窗口。报告显示,2019年我国药品审评审批效率持续提升,创新药与仿制药的研发与上市步伐显著加快,技术开发正成为驱动行业高质量发展的核心引擎。
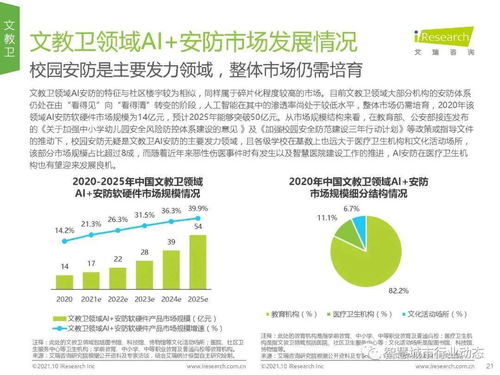
报告指出,2019年药品审评中心(CDE)完成审评审批的注册申请数量较往年有显著增长,其中纳入优先审评程序的药品数量大幅增加,这体现了国家对于临床急需、具有明显临床价值的药品研发给予的强力支持。特别是在抗肿瘤、抗病毒、罕见病治疗等领域,创新药的审评通过率与速度均呈现积极态势,一批具有自主知识产权的原创新药成功获批上市,标志着我国医药创新能力的实质性突破。
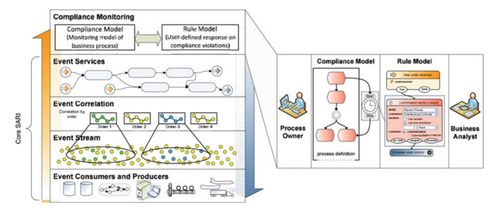
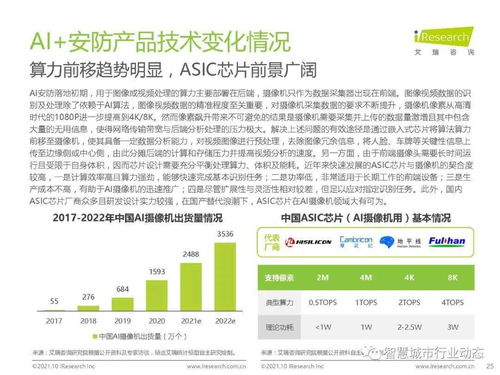
技术开发层面,报告着重强调了药品研发中新技术、新方法的应用与审评体系的适应性升级。2019年,基因治疗、细胞治疗等前沿生物技术产品的审评路径进一步明晰,相关技术指导原则陆续出台,为这类高风险、高技术产品的规范研发与审评提供了科学依据。仿制药质量与疗效一致性评价工作深入推进,通过严格的技术审评,确保仿制药与原研药在质量和疗效上达到一致,有力促进了药品可及性与行业整体技术水平的提升。
报告也反映出审评体系自身的技术能力建设在不断加强。通过优化审评流程、加强审评人员专业培训、推进审评信息化建设等措施,药品审评的科学性、规范性与透明度得到进一步提升。这为国内外制药企业的技术开发活动创造了更加稳定、可预期的政策环境,鼓励了更多资源投向高质量的创新研发。
综观报告,2019年度药品审评工作取得的成果,是我国深化药品审评审批制度改革、持续鼓励药物创新的直接体现。随着《药品管理法》的深入实施以及药品监管科学行动的持续推进,技术开发与审评体系的互动将更加紧密。企业需紧跟技术发展趋势,加强以临床价值为导向的研发创新;而监管机构也将继续完善基于风险的审评框架,护航安全、有效、高质量的药品惠及广大患者,共同推动我国从制药大国向制药强国迈进。
如若转载,请注明出处:http://www.grzhf.com/product/1.html
更新时间:2026-02-24 05:34:06